奇妙な病原体プリオン
志知 均(しち ひとし)
2013年12月
 |
| 家畜の牛や野生の鹿にプリオン病原体が発生した |
プリオン病原体(Prion disease)という言葉は狂牛病(Mad cow disease)のニュースで出てきたが、もう記憶にない人も多いと思う。しかし、アルツハイマー病(Alzheimer’s disease: 認知症)やパーキンソン病(Parkinson’s disease)などの脳神経疾患に関与していると聞けば関心をもたれるかもしれない。バクテリアやビールス(ウイルス)とはまったく異なるプリオンとは一体なんだろうか?
話は1950年代にさかのぼるが、人食い人種として知られるパプア・ニューギニア(Papua New Guinea)のフォア族(Fore)の部落民、特に女、子供が一年間に200人以上も原因不明の脳疾患クル病(kuru disease: ビタミンD不足でおきる狗屡病(rickets)とは無関係)で死亡していることが報告された。病原性バクテリアやビールスによる感染の痕跡はなかった。フォア族には病気で死んだ親族の脳組織を食べる習慣があることが人類学者の調査でわかっていたため、脳の中に未知の病原体が存在するだろうと推測された。
 |
| パプア・ニューギニア(左)とガジュセック |
私は、NIH(National Institute of Health: 国立衛生研究所)に勤務していた1970年頃に、カールトン・ガジュセック(Carleton Gajdusek)のクル病のセミナーをきいてたいへん興味をもった。ガジュセックはインディアナ・ジョーンズのような研究者でニューギニアのジャングルの奥にあるフォア族部落を訪れ,クル病で死亡した患者の脳組織をNIHへ持ち帰った。彼はその組織の抽出液をチンパンジーの脳に注射してクル病が発病することを示した。抽出液中の病原体は確認できなかったが、脳組織の病理所見が、病原体不明のもうひとつの脳疾患であるクロイツフェルド・ジャコブ病(Creutzfeldt-Jakob disease, CJD)にきわめて類似していることを指摘した。それは脳組織がスイス・チーズやスポンジのようになる病変で、これらの病気はスポンジ型脳障害(spongiform encephalopathies)と総称されている。ガジュセックはクル病その他の研究で1970年にノーベル賞を受賞した。
 |
| 脳障害の病原体の仮説 |
スポンジ型脳障害の病因については、遺伝子変異説、免疫説、毒性環境因子説など多様な説が出されたが、いずれも確証されなかった。1982年にカリフォルニア大学のスタンレー・プルシナー(Stanley B. Prusiner)は全く新しい発想から脳障害の病原体は、本来病原性のないタンパク質が特殊な異質構造になった時病原性になるとする仮説を発表した。当時、感染病の病原体はバクテリアやビールスなど遺伝情報因子(DNA, RNA)を持っており、感染により増殖するものとするのが常識であったから、感染性でしかも増殖するタンパク質病原体の仮説はほとんどの研究者に受け入れられなかった。
 |
| タンパク質の多い食べ物 |
プルシナーの仮説を要約すると次のようになる。タンパク質はアミノ酸が連鎖になってできるが、その連鎖が折れ曲がって三次構造になって完成する。正常構造の時は問題ないが、連鎖の折れ曲がりに変化が起きて異常構造になると、正常構造ではみられない作用をもつようになる。そのひとつは、正常構造の同類分子をどんどん異常構造に変えてしまう作用で、いわば正常構造への“感染”であり異常構造の“増殖”である。プルシナーはこのような異常構造になったタンパク質を総称してプリオン(prion:PRoteinaceous Infectious Particle, オンはparticleの意味)と命名した。プリオンについてもう少しわかりやすく説明すると、たとえば、卵の白みに熱をかけるとアルブミン蛋白質が構造変化をして白くなる。アルブミンはプリオンにならないから実際には起きないが、かたまりの白みを少量、熱をかけない白みにまぜた時(感染させた時)全体が固まりになる(増殖する)としたらそれがプリン化現象である。その後の研究でプリオン化するタンパク質はいろいろ見つかり、現在ではプリオン説は広く認められている。プルシナーはこの業績で1997年にノーベル賞を受賞した。
 |
| 顕微鏡下のプリオン病原体 |
プリオンが何故アルツハイマー病やパーキンソン病など加齢性脳神経疾患に関与すると考えられるのか? まず病気の加齢性については次のように説明される。正常構造のタンパク質が異常構造になると、細胞はそれを分解、除去しようとする。しかし加齢とともに異常構造ができやすくなり、その反面それを除去する機能は低下する。徐々にたまった異常構造がある程度以上になると異常構造の増殖がはじまる。少量のプリオンは有害でなくても、量が増えると脳細胞のはたらきを妨げるので病徴があらわれてくる。アルツハイマー病ではベータ・アミロイドとよばれるタンパク質が異常構造になり、かたまって脳神経細胞の外部に沈積してプラック(plaque)を形成する。またタウ(tau)とよばれるタンパク質が異常構造の糸くずのかたまりのようになり細胞内に蓄積する。身体の他の組織でできるのではなく、脳内でプリオンができることはマウスで証明されている。例えば、人工合成したベータ・アミロイドを脳内注射すると徐々に異常構造になって蓄積し6ヶ月後にプラックを形成する。
 |
| アミノ酸の構造 |
パーキンソン病ではアルファ・シニュクレンやパーキンとよばれるタンパク質が変異してプリオン状になり脳細胞に蓄積する。ゲーリック病で知られるALS(Amyotrophic Lateral Sclerosis)では活性酸素を分解する酵素が変異して異常構造になり、またハンテイントン病(Huntington disease)ではハンテインテインと呼ばれるタンパク質がプリオン状になるといわれている。18世紀に報告された羊の震せん病(scrapie)や、近年さわがれた狂牛病など動物の病気でもプリオンが関係する。ただし注意すべきことは、プリオン化したタンパク質がすべて病気を起こすわけではなく、プリオン構造になっても無害で生理活性をもつタンパク質はいくつか知られている。
現在プリオンが関係すると考えられる病気はほとんどが脳神経疾患である。その理由はまだよくわからないが、可能性として、病原性プリオンになるのは神経細胞の働きに関与するタンパク質が多いからかもしれない。そうであれば神経細胞の固まりといえる脳にプリオン病が起きやすいのが理解できる。しかし何故そのようなタンパク質が必要量以上に脳に溜まってくるのか?脳が大量に必要とする酸素やグルコースは血管で運ばれてくる。ヒトの脳には860億の神経細胞があり4億の血管が脳全域を網羅している。血液成分の中には脳細胞の機能に好ましくないものがあるから、それが脳へ入らないようにするための障壁(Blood Brain Barrier; BBB)が血管壁に存在する。加齢、組織損傷、炎症、毒物などが原因でBBBのはたらきが悪くなると血液中のタンパク質が脳の各所へ流入することになる。当然、プリオンになるタンパク質の脳内濃度も高くなる。異なるプリオンが脳内のどこで増えるかによって病名の違う多様な脳神経疾患が現われるのではないだろうか。
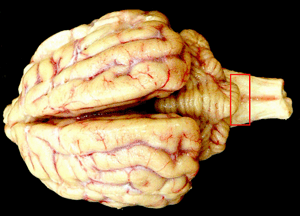 |
| 赤線で囲まれた部分にプリオンが溜まる |
プリオン病対策としては、まず、プリオン化するタンパク質が脳に増えないようにすること、正常構造のタンパク質のプリオン化を防ぐこと、またプリオン化したタンパク質を速やかに除去すること、などが考えられる。残念ながらこれらの対策に有用な薬物の開発は実用化のレベルに至っていない。従って生活態度で自己防衛するしかないが、どうすればよいだろうか? 初期の007映画でション・コネリー扮するジェームス・ボンドがデイナーに猿の脳味噌を出されて当惑する場面があったが、たとえ珍味であっても動物の脳の料理は食べないこと、またBBBの機能が低下しないように酒やタバコはほどほどにして、また頭を怪我しないよう気を付けることぐらいだろう。
ともあれ、プリオンの研究がさらに進み種々の脳疾患に有効な治療と予防の方法が開発されることが望まれる。














素人考えですが、どうやら酒やタバコを控え、粗食に甘んじ、規則正しい生活をし、適度に運動することで病気を避けられるような気がします。
返信削除